北京時間2020年7月17日,我校77779193永利官网、生命科學技術學院李姗教授課題組以“Arg-GlcNAcylation of TRADD by NleB and SseK1 is crucial for bacterial pathogenesis” 為題,在《Frontiers in Cell and Developmental Biology》雜志發表研究論文。文章揭示A/E緻病菌通過三型分泌系統效應蛋白NleB/SseK1操縱TRADD介導的信号傳導,進而逃避宿主的免疫防禦機制,為後續相關的研究提供新思路。
腸緻病性大腸杆菌(EPEC)和鼠傷寒沙門氏菌(S. Typhimurium)是重要的食源性細菌,兩者均分泌具有Arg-GlcNAc轉移酶活性的三型分泌系統效應蛋白NleB/SseKs。精氨酸 N-乙酰葡萄糖胺化修飾是一種全新的翻譯後修飾,可作用于宿主細胞的死亡結構域,抑制宿主死亡受體所介導的細胞死亡。人類基因組中的死亡受體結構域蛋白,多數也都與炎症反應或者細胞死亡信号通路有關。對所有的死亡結構域進行比對,發現有三分之一的蛋白在TRADD的第235位精氨酸所對應的位置擁有保守的精氨酸。
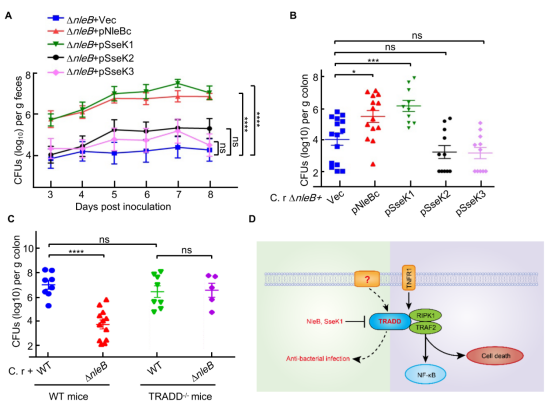
基于上述發現,李姗課題組在EPEC和沙門氏菌感染期間對含有保守的精氨酸的12個死亡域蛋白進行有限的底物篩選,以鑒定NleB/SseK的生化活性及生理底物。結果發現,EPEC的NleB可修飾TRADD DD,FADD和RIPK1 DD,沙門氏菌的SseK1和SseK3分别通過TRADD Arg235/Arg245和TNFR1 Arg376劫持死亡受體信号。且SseK1完全消除了TRADD過表達誘導的NF-κB激活和細胞凋亡。NleB在體外的底物存在廣泛性,然而體内的生理底物一直是未解之謎。利用SseK1和SseK3的底物特異性,在小鼠感染模型中,課題組發現,隻有SseK1可以回補細菌定植缺陷,而SseK3是不能的,并且TRADD缺失小鼠也證明TRADD是細菌感染過程中NleB的靶标。SseK3可靶向TRADD的上遊受體TNFR1破壞TNF信号傳導。 但抑制TRADD而不是TNFR1有利于細菌定植,這一發現也強調了TRADD在TNFR1和non-TNFR1信号轉導中的抗菌感染作用。
本項目受到科技部重點研發計劃、國家自然科學基金、77779193永利官网自主創新基金以及十堰市太和醫院人才啟動基金支持。李姗為該論文通訊作者,碩士研究生胡樹繁,黃宇軒,張琦,易雪瑩,博士研究生潘興有重要貢獻。
2020年以來,李姗課題組在前期工作基礎上(Li et al., Nature, 2013; Ding et al., Molecular Cell, 2019),先後發表論文揭示NleB/SseK糖基化自修飾的生理功能(Xue et al., Frontiers in Cellular and Infection Microbiology, 2020), SseK3全新的底物篩選及功能研究(Meng et al., Communications Biology, 2020),并發文綜述精氨酸糖基化修飾類型及反應機理(Pan et al., Frontiers in Cellular and Infection Microbiology, 2020)。

