2020年5月5日,我院李姗教授團隊在《Frontiers in Cellular and Infection Microbiology》雜志在線發表了題為“Auto arginine-GlcNAcylation is crucial for bacterial pathogens in regulating host cell death”的研究論文。文章揭示了病原微生物三型分泌系統效應蛋白NleB/SseK精氨酸糖基化自修飾對調控宿主細胞死亡的重要意義。
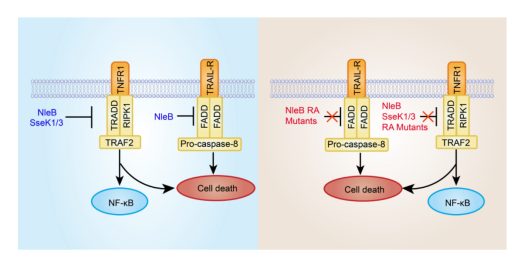
許多革蘭氏陰性細菌可利用三型分泌系統(T3SS)将毒力因子(稱為效應蛋白)注入宿主細胞,進而操縱宿主細胞的信号傳導,以利于病原菌的入侵。李姗教授的前期工作發現三型效應蛋白 NleB 家族,以一種全新的精氨酸 N-乙酰葡萄糖胺化修飾作用于宿主細胞的死亡結構域,從而抑制了宿主死亡受體所介導的細胞死亡(Li et al., Nature, 2013)。随後研究團隊又解析了精氨酸N-乙酰葡萄糖胺化修飾後的死亡受體(TRADD-DD和FADD-DD)的晶體結構,揭示了NleB作用于死亡受體家族進而使其發生精氨酸N-乙酰葡萄糖胺化修飾的分子作用機制(Ding et al., Molecular Cell, 2019)。沙門氏菌(Salmonella entrica)分泌的SseK1,SseK2和SseK3屬于NleB的同源蛋白,SseK1/2/3同樣可以使細胞中的死亡受體及其接頭蛋白發生精氨酸N-乙酰葡萄糖胺化修飾。
在探究NleB/SseK的亞細胞定位時,我們偶然地發現了NleB和SseK1/3的糖基化自修飾現象(Auto-GlcNAcylation)。通過蛋白質二級質譜鑒定到了自修飾位點,分别是NleB中的Arg13/53/159/293,SseK1中的Arg30/158/339和SseK3中的Arg153/184/305/335。文章還發現,真核轉染體系下,糖基化自修飾能力的缺失降低了NleB對底物TRADD的結合能力;細菌感染體系下,NleB和SseK1/3自修飾位點的突變減弱或消除了對其死亡受體的修飾能力。更重要的是,失去了糖基化自修飾能力的病原菌不再能夠抑制TNF或TRAIL-誘導的細胞死亡。文章系統的揭示了NleB/SseK糖基化自修飾的生理功能,這對于全面認識精氨酸N-乙酰葡萄糖胺化修飾具有重要意義。
我院李姗教授為該論文通訊作者。本項目受到科技部重點研發計劃、湖北省教育廳創新團隊計劃、77779193永利官网自主創新基金(華農-太和專項)支持。
原文鍊接:https://www.frontiersin.org/articles/10.3389/fcimb.2020.00197/

