近日,我校77779193永利官网金紅林教授課題組與華中科技大學同濟醫學院楊坤禹教授課題組合作的研究成果以“Peptide hydrogels loaded with irradiated tumor cell secretions enhance cancer immunotherapy”為題在Nano Today發表。研究搭建了一種多功能抗腫瘤水凝膠平台,用于開拓放射衍生物在抗腫瘤免疫治療中的新用途。
免疫治療,特别是針對程序性死亡-1(PD-1)/程序性死亡配體1(PD-L1)通路的免疫檢查點阻斷(ICB),已經改變了癌症的治療範式。但臨床數據顯示,僅有一小部分患者(通常10-30%的應答率)對ICB有應答。這是由于在晚期癌症中,T細胞恢複和腫瘤負荷之間的不平衡是限制PD-1/PD-L1阻斷治療療效的主要障礙之一。因此,能同時減輕腫瘤負荷和重塑腫瘤微環境(TME)的策略,可提高PD-1/PD-L1阻斷治療在晚期癌症患者中的臨床療效。
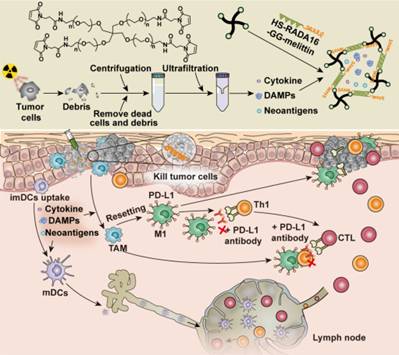
該研究發現,放療後腫瘤細胞的超濾濃縮液(RT-UF)可高效刺激樹突狀細胞的活化和成熟。此外,RT-UF含有招募巨噬細胞的趨化因子,比如MIP-1, G-CSF, LIX和PF4等,可将巨噬細胞的表型極化為抗腫瘤的M1表型。RT-UF能有效地重塑TME,但由于其代謝過快且攝取效率低,導緻其抗腫瘤作用不強。為此,該團隊自主研制了一種PEG和melittin-peptide(蜂毒肽)交聯的治療肽水凝膠,具有藥物緩釋,改善細胞膜通透性,快速誘導腫瘤細胞死亡等特性。基于此優勢構建了超濾液負載的雜化蜂毒肽水凝膠(UF@MRP)用于高負荷腫瘤治療。在多個ICB治療不能有效控制的腫瘤模型中,瘤内給藥UF@MRP可增強ICB療效,延長生存時間。數據表明,UF@MRP和抗PD -1單克隆抗體聯用可治愈約43%的惡性腹水小鼠,且在治愈的小鼠上産生了強烈的免疫記憶效應。活體顯微成像技術也證實,該聯合治療方式産生的抗腫瘤T細胞在細胞數量、運動活力和趨向性方面獲得了較大的提升。更為重要的是,該治療效應不依賴于RT-UF的腫瘤細胞來源,顯示出廣譜的抗腫瘤效應。
該研究的意義包括:發現了放療超濾液具有較強免疫調節功能,可重塑腫瘤免疫微環境;通過優化的蜂毒肽水凝膠負載放療超濾液,可發揮強效的抗腫瘤療效應;以惡性腹水小鼠為模型,提出了一種“腫瘤間接放療”的思路,實現了對局部晚期及廣泛轉移腫瘤的有效控制,具有較強的臨床轉化價值。
金紅林教授和楊坤禹教授為文章共同通訊作者。本研究受到了國家自然科學基金優秀青年基金項目的資助。
【英文摘要】
In advanced stage patients, traditional cancer chemotherapies often demonstrate limited tumor growth inhibition and fail to elicit sufficient anti-tumor immunity required for long-lasting responses. Herein, we developed a therapeutic peptide hydrogel manufactured using a PEG cross-linked melittin-peptide scaffold that not only itself induces tumor cell killing, but also encapsulates the processed cell secretions of autologous, irradiated tumor cells. MLT-RADA-Polyethylene glycol (MRP) loaded with the concentrated ultrafiltration (UF) retentate from irradiated tumor cell media, denoted as UF@MRP effectively reshapes the tumor microenvironment (TME) by stimulating dendritic cell maturation and reprogramming macrophages toward a tumoricidal M1 phenotype. In multiple murine tumor models, in which immune checkpoint blockade (ICB) alone did not control advanced disease, intratumoral administration of UF@MRP enhanced ICB efficacy, leading to prolonged survival. The combination of UF@MRP and ICB appears to be an effective approach to rapidly kill tumor cells, diminish immunosuppression in the TME, and activate host adaptive immune responses, all of which work in concert in an immunotherapy regime to control established and aggressive tumors.
論文鍊接:https://www.sciencedirect.com/science/article/pii/S1748013221002486

